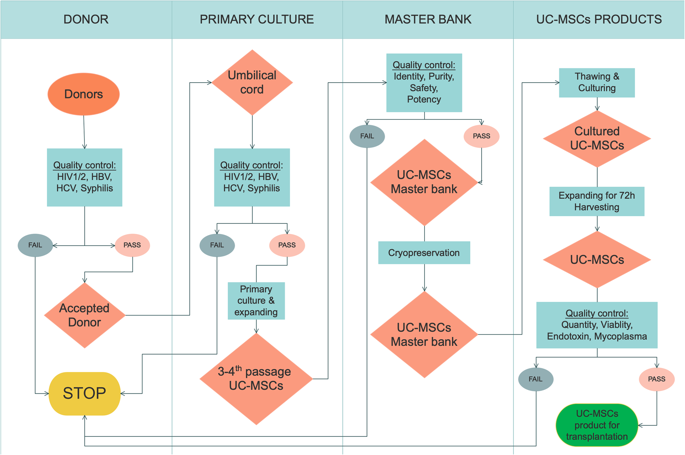
Công nghệ sản xuất tế bào gốc trung mô từ mô dây rốn người (UC-SCI) của Viện Tế bào gốc là công nghệ toàn diện và đồng độ cho sản xuất tế bào gốc quy mô nhỏ (trong chai nuôi cấy) và lớn (trong bioreactor).
- Đồng bộ từ khâu thu nhận dây rốn đến khâu nuôi cấy sơ cấp, nuôi cấy tăng sinh và bảo quản tế bào gốc trung mô sau khi tăng sinh
- Sử dụng dung dịch vận chuyển mô, môi trường nuôi cấy và môi trường bảo quản chuyên dụng
- Quy trình được chuẩn hoá với hiệu suất và năng suất cao, tiết kiệm đáng kể chi phí sản xuất và rút ngắn thời gian sản xuất tối đa
- Quy trình công nghệ thực hành theo các hướng dẫn của GMP-WHO cho sinh phẩm.
Sản phẩm tế bào gốc thu thu từ công nghệ UC-SCI đã được cho phép thử nghiệm lâm sàng trên người trong điều trị bệnh phổi tắc nghẽn mạn tính và bệnh đái tháo đường.
Quy trình:
Bước 1: THU – VẬN CHUYỂN DÂY RỐN
Dây rốn sau khi thu được có thể bảo quản trong Transfering Medium
Bước 2: RỬA DÂY RỐN
Tại PTN, dây rốn được rửa sạch máu bằng Washing Buffer
Bước 3: TÁCH MẠCH MÁU VÀ THU MÔ
Bước 4: NUÔI CẤY SƠ CẤP
Nuôi cấy sơ cấp bằng môi trường MSCCult I Primary
Bước 5: TĂNG SINH
Tăng sinh bằng Deattachment và MSCCult hoặc MSCCult I
Bước 6: TĂNG TÍN HIỆU ĐIỀU BIẾN MIỄN DỊCH (TÙY CHỌN)
Sử dụng ImmunoAdd
Bước 7: TĂNG KHẢ NĂNG TIẾT (TÙY CHỌN)
Sử dụng SecretoAdd
Bước 8: BẢO QUẢN
Sử dụng Cryosave I, II, III
CÁC SẢN PHẨM CHÍNH SỬ DỤNG TRONG QUY TRÌNH CÔNG NGHỆ

MSCCULT I PRIMARY
Là môi trường chuyên biệt cho nuôi cấy sơ cấp tế bào gốc từ dây rốn
Sản phẩm hoàn toàn vô trùng, sẵn sàng sử dụng Quy trình đơn giản, thời gian thu nhận tế bào nhanh chóng

MSCCULT I
Là môi trường chuyên biệt cho nuôi cấy tăng sinh tế bào gốc từ mô dây rốn,
Không dung huyết thanh bò, không dùng protein từ động vật, dễ sử dụng, không cần coating
Đảm bảo vô trùng tuyệt đối

CRYOSAVE
Là môi trường bảo quản tế bào với 3 thế hệ sản phẩm (Cryosave I, Cryosave II, Cryosave III) phù hợp cho mục đích nghiên cứu và sản xuất.
Vô trùng tuyệt đối, sẵn sàng sử dụng
Hiệu quả bảo quản tế bào cao, tỷ lệ tế bào sống sau giải đông tối ưu
Các nghiên cứu sử dụng công nghệ UC-SCI:
1/ Le Thi Bich, P., Nguyen Thi, H., Dang Ngo Chau, H. et al. Allogeneic umbilical cord-derived mesenchymal stem cell transplantation for treating chronic obstructive pulmonary disease: a pilot clinical study. Stem Cell Res Ther 11, 60 (2020). https://doi.org/10.1186/s13287-020-1583-4
2/ Pham, P., Vu, N., Nguyen, H., & Phan, N. (2016). Isolation of endothelial progenitor cells from human adipose tissue. Biomedical Research and Therapy, 3(05), 645-652. https://doi.org/10.15419/bmrat.v3i05.98
3/ Dao T.TT. et al. (2017) In Vitro Production of Cartilage Tissue from Rabbit Bone Marrow-Derived Mesenchymal Stem Cells and Polycaprolactone Scaffold. In: Pham P. (eds) Tissue Engineering and Regenerative Medicine. Advances in Experimental Medicine and Biology, vol 1084. Springer, Cham
Quy trình sản xuất và kiểm soát chất lượng của UC-SCI

Phòng Thông tin Truyền thông và Tổ chức Sự kiện Viện Tế Bào Gốc